+ Tên oxit axit = tên yếu tắc phi kim (kèm tiền tố chỉ số nguyên tử kim loại hoặc phi kim) + oxit (kèm chi phí tố chỉ số nguyên tử oxi)
Một số tiền tố chỉ số nguyên tử: mono : 1; đi : 2; Tri : 3.....
Bạn đang xem: Tổng hợp kiến thức hóa học lớp 9
VD: CO2 : Cacbon dioxit
P2O5: Đi photpho penta oxit
+ Tên oxit bazo = Tên yếu tố kim loại (kèm hóa trị nếu nguyên tố kim loại có rất nhiều hóa trị) + oxit
VD: Fe2O3 : fe (III) oxit
Tính chất hóa học
Oxit axit | Oxit bazo |
a. Chức năng với nước → hỗn hợp axit VD: SO2 + H2O → H2SO3 b. Công dụng với dd bazo → muối bột + H2O CO2 + Ca(OH)2 → Ca c. Công dụng với oxit bazo → Muối (Một số oxit bazo bao gồm thể công dụng với oxit axit: K2O, Na2O, Ba SO2 + Ba | a. Tác dụng với nước → hỗn hợp bazo (kiềm) Ba b. Công dụng với axit → muối hạt + Nước Fe c. Công dụng với oxit axit → Muối SO2 + Ba |
Oxit lưỡng tính | Oxit trung tính |
Oxit lưỡng tính vừa chức năng với hỗn hợp axit, vừa chức năng với dung dịch bazo để sinh sản thành muối với nước Al2O3 + 6HCl → 2Al Al2O3 + 2Na | Oxit trung tính là đầy đủ oxit không tác dụng với axit, bazo tốt với nước VD: NO, CO, N2O,... |
III. AXIT
Axit là hợp chất mà phân tử bao gồm một hay nhiều nguyên tử hidro liên kết với gốc axit.
CTTQ: Hn
A
VD: HCl, H2SO4, HNO3, H3PO4...
Cách hotline tên:
a. Axit không tồn tại oxi: thương hiệu axit = Axit + thương hiệu phi kim + hidric
VD: HCl: axit clohidric
HF: axit flohidric
b. Axit có oxi: Tên axit = Axit + thương hiệu phi kim + ic
VD: H2SO4 : Axit sunfuric
HNO3: Axit nitric
Axit có ít nguyên tử oxi : tên axit = Axit + tên phi kim + ơ
VD: H2SO3 : Axit sunfurơ
Tính chất hóa học
a. Đổi màu hóa học chỉ thị
Axit làm chuyển màu quỳ tím sang màu đỏ
b. Công dụng với oxit bazo => muối hạt + H2O
VD: H2SO4 + Ba
O → Ba
SO4 + H2O
c. Công dụng với bazo => muối hạt + H2O
VD: 2HCl + Cu(OH)2 → Cu
Cl2 + 2H2O
d. Công dụng với kim loại => muối hạt + H2
(dung dịch HCl, H2SO4 chức năng KL (trừ một số KL: Ag, Cu, ...)
H2SO4 + fe → Fe
SO4 + H2
e. Tính năng với muối => Muối bắt đầu + axit mới
(Sản phẩm xuất hiện là hóa học dễ bay hơi. Hoặc muối bắt đầu không tan)
* giữ ý:
Al, Fe, Cr thụ động trong HNO3 quánh nguội, H2SO4 đặc nguội
H2SO4 đặc nóng, HNO3 tác dụng với hầu như các kim loại (trừ Au, Pt) và không sinh ra khí H2
Cu + H2SO4 sệt → Cu
SO4 + SO2 + 2H2O
IV. BAZO
Bazo là thích hợp chất bao gồm một nguyên tử kim loại links cới một hay nhiều nhóm hidroxit (OH)
CTTQ: M(OH)n
VD: Na
OH; Fe(OH)3
Cách gọi tên bazo:
Tên bazo = Tên yếu tố kim loại (kèm hóa trị nếu nguyên tố hóa trị có khá nhiều hóa trị) + hidroxit
VD: Fe(OH)2 : fe (II) hidroxit
Na
OH: Natri hiroxit
Tính chất hóa học
- Tác dụng với axit => muối bột + H2O
Ca(OH)2 + H2SO4 → Ca
SO4 + 2H2O
- Bazo tan có tác dụng đổi màu chất chỉ thị
+ Qùy tím gửi thành màu xanh, phenol phtalein đưa thành màu sắc hồng
- Bazo tan chức năng với oxit axit => muối hạt + H2O
Ba(OH)2 + CO2 → Ba
CO3 + H2O
- Bazo tan tính năng với hỗn hợp muối => Muối mới + Bazo mới
(ĐK: thành phầm sinh ra cần có ít nhất 1 hóa học kết tủa)
2Na
OH + Cu
SO4 → Cu(OH)2 + Na2SO4
- Bazo ko tan bị nhiệt độ phân diệt => Oxit bazo + H2O
Cu(OH)2 .(xrightarrowt^0).Cu
O + H2O
V. MUỐI
Muối là hợp chất mà phân tử có một hay nhiều nguyên tử kim loại link với một hay những gốc axit
CTTQ: Ax
By
A là kim loại, B là nơi bắt đầu axit
VD: K2SO4; Ca
CO3, ...
Tên gọi:
Muối trung hòa: Tên yếu tắc kim loại (kèm hóa trị nếu như nguyên tố kim loại có khá nhiều hóa trị) + Tên nơi bắt đầu axit
VD: Na2SO4 : Natri sunfat
Muối axit : Tên nguyên tố sắt kẽm kim loại + hidro + tên cội axit
VD: Na
HCO3 : Natri hidrocacbonat
Tính chất hóa học
-Dung dịch muối + sắt kẽm kim loại → Muối mới + KL mới
VD: Cu
SO4 + sắt → Fe
SO4 + Cu
- Muối + axit → Muối mới + axit mới
(Sản phẩm sinh ra phải có chất kết tủa, hoặc khí bay ra)
VD: Ca
CO3 + HCl → Ca
Cl2 + CO2 + H2O
- Dung dịch muối hạt + hỗn hợp bazo => Muối new + bazo mới
(Sản phẩm sinh ra bắt buộc có ít nhất 1 chất kết tủa)
VD: Cu
SO4 + Na
OH → Cu(OH)2 + Na2SO4
- Dung dịch muối bột + dung dịch muối => 2 muối hạt mới
(Sản phẩm sinh ra đề nghị có tối thiểu 1 chất kết tủa)
VD: Na2SO4 + Ba
Cl2 → Ba
SO4 + Na
Cl
VI. Quan hệ giữa các hợp hóa học vô cơ
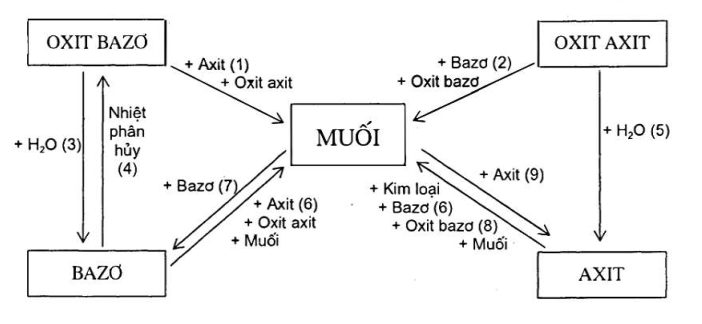
CHƯƠNG 2: KIM LOẠI
I. Tính chất vật lý
- Tính hóa học chung: Tính dẻo, dẫn điện, dẫn nhiệt cùng ánh kim
- Tính chất riêng: khối lượng riêng (D) ; nhiệt độ nóng chảy, độ cứng
II. đặc điểm hóa học
- tính năng với phi kim
Tác dụng cùng với oxi => Oxit kim loại
(Trừ một số trong những kl như Ag, Au, Pt)
Fe + O2 → Fe2O3
Tác dụng với phi kim khác => Muối
Ca + Cl2 → Ca
Cl2
- chức năng với axit
+ KL + Axit (HCl ; H2SO4 loãng) => muối bột + H2
Mg + H2SO4 → Mg
SO4 + H2
+ KL + Axit (HNO3, H2SO4 đ) => muối bột + thành phầm khử + H2O
Cu + H2SO4 đ → Cu
SO4 + SO2 + H2O - tác dụng với hỗn hợp muối => Muối mới + KL mới
Cu + 2Ag
NO3 → Cu(NO3)2 + 2Ag
III. Dãy hoạt động hóa học tập của kim loại
K Na tía Ca Mg Ak Zn fe (H) Cu Hg Ag Pt Au
Ý nghĩa dãy chuyển động hóa học tập của kim loại:
+ Đi tự trái thanh lịch phải, mức độ hóa học của sắt kẽm kim loại giảm dần
+ sắt kẽm kim loại đứng trước Mg, làm phản ứng cùng với nước ở điều kiện thường chế tác thành dung dịch kiềm hóa giải khí hidro
+ sắt kẽm kim loại đứng trước H phản bội ứng với một trong những dung dịch axit (HCl, H2SO4, ...) giải hòa khí hidro
+ kim loại đứng trước (trừ Na, K, Ca, Ba, ...) đẩy được kim loại đứng sau ra khỏi dung dịch muối
IV. SO SÁNH TÍNH CHẤT CỦA NHÔM VÀ SẮT
| Nhôm – Al (NTK : 27) | Sắt – fe (NTK : 56) |
1. đặc điểm vật lí | Màu white bạc, bao gồm ánh kim, nhẹ, dẻo, dẫn điện, dẫn điện tốt | Màu trắng xám, bao gồm ánh kim, nặng, dẻo, dẫn điện, dẫn nhiệt độ tốt, nhưng lại kém rộng nhôm |
2. đặc điểm hóa học | Đều mang không thiếu thốn tính chất hóa học của KL | |
a. Với phi kim | 2Al + 3S (xrightarrowt^0)Al2S3 | Fe + S (xrightarrowt^0)Fe |
b. Với oxi | 2Al + O2 → 2Al2O3 | Fe + O2 → Fe3O4 |
c. Cùng với axit | 2Al + 6HCl → 2Al | Fe + 2HCl → Fe |
Cả Al, Fe phần đa không công dụng với HNO3, H2SO4 quánh nguội | ||
d. Với hỗn hợp muối | 2Al + 3Fe | Fe + 2Ag |
e. Với hỗn hợp kiềm | 2Al + 2Na | Không phản ứng |
3. Thích hợp chất | Al2O3 cùng Al(OH)3 bao gồm tính lưỡng tính Al2O3 + 6HCl → Al Al2O3 + 2Na Al(OH)3 + 3HCl → Al Al(OH)3 + Na | Fe |
4. Sản xuất | Nguyên liệu: Quăng boxit tất cả thành phần đa phần là Al2O3 và criolit 2Al2O3 (xrightarrowt^0) 4Al + 3O2 | Nguyên liệu: Quặng sắt (Manhetit, hemantit,...) |
V. đúng theo kim
1. Hòa hợp kim
Là chất rắn nhận được khi làm cho nguội các thành phần hỗn hợp nóng chảy của tương đối nhiều kim loại khác biệt hoặc của sắt kẽm kim loại và phi kim.
Gang | Thép | |
- Gang là hợp kim của sắt với cacbon và một số nguyên tố không giống (Mn, Si, S, ...) trong các số đó hàm lượng C trường đoản cú 2 – 5% - bao gồm 2 loại gang: + Gang trắng dùng làm luyện thép + Gang xám để sản xuất máy móc, thiết bị | - Thép là kim loại tổng hợp của sắt và Cacbon, một số trong những nguyên tố khác trong những số ấy làm lượng C 3O4; Hemantit: Fe2O3,...) - Than cốc, ko khí, ... Dùng co khử những oxit fe ở ánh sáng cao trong lò luyện kim. Xem thêm: Những Loại Thuốc Tránh Thai Có Mấy Loại? Bạn Hợp Với Loại Nào? * Qúa trình sản xuất: - làm phản ứng chế tạo CO: C + O2 (xrightarrowt^0) CO2 C + CO2 (xrightarrowt^0) 2CO - Khử oxit sắt Fe2O3 + 3CO (xrightarrowt^0) 2Fe + 3CO2 Fe3O4 + 3CO (xrightarrowt^0) 3Fe + 4CO2 - tạo xỉ: Ca | Sản xuất: * Nguyên liệu: - Gang; - Sắt phế truất liệu - Khí oxi * nguyên lý sản xuất: Oxi hóa các kim loại, phi kim để các loại khỏi gang nhiều phần các yếu tắc C, S, P, Mn, Si, ... * Qúa trình sản xuất: - làm phản ứng sản xuất Fe 2Fe + O2 (xrightarrowt^0) 2Fe - Fe Fe |
VI. SỰ ĂN MÒN KIM LOẠI VÀ BẢO VỆ KIM LOẠI KHÔNG BỊ ĂN MÒN
1. Sự bào mòn kim loại
Sự tàn phá kim các loại và hợp kim trong môi trường tự nhiên do tính năng hóa học hotline là sự làm mòn kim loại
2. Phần đông yếu tố ảnh hưởng đến sự làm mòn kim loại
- nhiệt độ: ánh nắng mặt trời cao, bào mòn nhanh
- các chất vào môi trường: ẩm, các chất OXH thì ăn mòn nhanh
3. Các phương pháp bảo đảm an toàn kim loại không xẩy ra ăn mòn
- Ngăn quán triệt kim một số loại tiếp xúc với môi trường thiên nhiên xung quanh
- chế tạo các vừa lòng kim có chức năng chống, chịu ăn mòn
CHƯƠNG 3: PHI KIM
I. TÍNH CHẤT VẬT LÝ CỦA PHI KIM
- Ở điều kiện thường, các phi kim tồn tại nghỉ ngơi cả 3 trạng thái: rắn, lỏng, khí.
- đa số các phi kim ko dẫn điện, dẫn sức nóng kém, không tồn tại ánh kim
- một số trong những phi kim độc như: Cl2, Br2, I2, ...
II. TÍNH CHẤT HÓA HỌC
1. Chức năng với sắt kẽm kim loại => muối hạt (hoặc oxit)
VD: Hg + S → Hg
S
2. Tác dụng với hidro => Hợp hóa học khí
VD: H2 + Cl2 → 2HCl
3. Nấc độ buổi giao lưu của phi kim
Mức độ chuyển động hóa học mạnh hay yếu của những phi kim xét dựa vào khả năng tính năng của phi kim với sắt kẽm kim loại và hidro
Thứ tự vận động giảm dần dần theo dãy:
F > O > Cl > Br > S > phường > C > Si
III. Clo
Tính hóa học vật lý:
Là chất khí màu xoàn lục, mùi hắc, tan một trong những phần trong nước. Clo là khí độc
Tính hóa học hóa học:
Clo tất cả những đặc điểm hóa học phổ biến cua phi kim
+ Clo + sắt kẽm kim loại → Muối
Cl2 + fe → Fe
Cl3
+ Clo + Hidro => Khí hidro clorua
Cl2 + H2 → 2HCl
Tính hóa học khác:
Tác dụng cùng với nước:
Cl2 + H2O → HCl + HCl
O
Cl2 + Na
OH → Na
Cl + Na
Cl
O + H2O
Điều chế
Trong chống thí nghiệm:
Dùng hóa học oxi hóa bạo gan (Mn
O2, KMn
O4, ...) + HCl đặc
VD: Mn
O2 + 4HCl → Mn
Cl2 + Cl2 + 2H2O
Trong công nghiệp:
Điện phân dung dịch Na
Cl bão hòa bao gồm màng phòng xốp
2Na
Cl + 2H2O → 2Na
OH + Cl2 + H2
IV. CACBON VÀ HỢP CHẤT CACBON
1. Dạng thù hình của cacbon
Có 3 loại thù hình chính: Kim cương, than chì, cacbon vô định hình
2. đặc điểm của cacbon
+ Tính hấp phụ: cacbon vô định hình có tác dụng hấp phụ hóa học khí, chất màu trên bề mặt chúng
Chương trình Hóa 9 là chương trình có rất nhiều kiến thức, đòi hỏi các bạn học sinh cần phải nắm chắc chắn lý thuyết tương tự như các công thức. Vậy, hãy thuộc WElearn gia sư tìm hiểu các cách làm hóa học lớp 9 nhằm giúp các bạn học sinh tự tin hơn lúc làm bài xích tập nhé!
1. Chương trình hóa học tập lớp 9
Chương 1: Các loại hợp chất vô cơChương 2: Kim loại
Chương 3: Phi kim
Chương 4: Hiđrocacbon. Nhiên Liệu
Chương 5: Dẫn xuất của Hidrocacbon. Polime
2. Tổng hợp những kiến thức trọng tâm
Các kiến thức cơ bản

Chương 1: Các loại hợp chất vô cơ
Dạng bài tập oxit bazo tác dụng với axit: Sử dụng định luật bảo toàn khối lượng hoặc phương pháp tăng giảm khối lượng.Dạng bài tập oxit axit tác dụng với bazo: Xét tỉ lệ để xác định muốiCho CO2/SO2 vào hỗn hợp kiềm MOH: T =

Cho CO2/SO2 vào dung dịch kiềm M(OH)2: T =

T ≥ 2: chỉ chế tác muối axit1 mbình tăng = mchất hấp thụmdd tăng = mchất dung nạp – mkết tủamdd bớt = mkết tủa – mchất hấp thụ
Dạng axit tác dụng với kim loại: Kim loại + Axit loại 2 -> Muối + Sản phẩm khử + H2ODạng axit tác dụng với bazo: m
Hn
A + n
M(OH)m → Mn
Am + m.n
H2ODạng axit, bazo, muối tác dụng với muối:Axit + muối hạt → muối mới + axit mới
Bazơ + muối → muối new + bazơ mới
Muối + muối bột → 2 muối mới
Dạng kim loại tác dụng với muối:m
KL↑= m
KL phụ thuộc vào – m
KL chảy ra m
KL↓ = m
KLtan ra – m
KL bám vào
Chương 2: Kim loại
m sắt kẽm kim loại giải phóng – m kim loại tan = m kim loại tăngm sắt kẽm kim loại tan ra – m kim phụ thuộc vào = m kim loại giảmKhối lượng thanh kim loại tăng lên x% so với trước lúc nhúng ta có: m kim loại bám vào – mkim nhiều loại tan ra = mbđ.x%Khối lượng thanh kim loại giảm sút x% so với trước khi nhúng ta có: mkim một số loại tan ra – mkim loại phụ thuộc vào = mbđ.x%Bảo toàn khối lượng: Tổng trọng lượng các hóa học tham gia = Tổng khối lượng các hóa học tạo thànhm thanh kim loại + mdd = m’ thanh sắt kẽm kim loại + m’ dd
Phản ứng nhiệt nhôm: n
H2=n
Fe+3/2n
Al
Khối lượng muối thu được lúc cho sắt kẽm kim loại phản ứng hết với HCl (hoặc H2SO4 loãng): mmuối = m
KL + m gốc axitm muối bột sunfat = m tất cả hổn hợp KL + 96.n
H2m muối clorua = m hỗn hợp KL +71.n
H2
Chương 3: Phi kim
Trong các phản ứng của C, CO, H2 thì số mol CO= n
CO2, n
C= n
CO2, n
H2= n
H2O.
Các phương pháp về nguyên tử
STT ô nguyên tố = số hiệu nguyên tử = số proton = số electron.STT chu kì = số lớp electron.STT của các nhóm A = số electron ở lớp bên ngoài cùng của nguyên tử trong team đó.Chương 4: Hiđrocacbon. Nhiên Liệu
Bảo toàn khối lượng: mO = a – (m
C + m
H + m
N)

H2O > n
CO2 ⇒ CTPT Cn
H2n+2 và n
Cn
H2n+2 = n
H2O – n
CO2n
H2O = n
CO2 ⇒ CTPT Cn
H2nn
H2O CO2 ⇒ CTPT Cn
H2n-2 và n
Cn
H2n-2 = n
CO2 – n
H2OĐộ bất bão hòa của thích hợp chất: Cx
Hy
Oz
Nt
Xv (với X là các nguyên tố đội halogen):

Hy
Oz
Dựa vào khối lượng mol hợp hóa học hữu cơ: M = 12x + y + 16z (g/mol)Dựa vào công thức liên hệ giữa cân nặng và số mol: M = m/n
Dựa vào tỉ khối (Áp dụng với những chất khí):MA =

A/KK.29

Chương 5: Dẫn xuất của Hidrocacbon. Polime
Công thức tính độ rượu:

Công thức tính khối lượng riêng:

2n
C6H12O6 = n
Ag
3. Những công thức hóa học lớp 9


Công thức tính hiệu suất phản ứng (H; solo vị: %)
Tính theo trọng lượng chất sản phẩm: H = mTT/m
LT.100%Tính theo số mol chất tham gia: H=nphản ứng/nban đầu.100%
Công thức tính trọng lượng chất gia nhập khi gồm hiệu suất: m thực tế =mlt.100/H
Công thức tính cân nặng sản phẩm khi bao gồm hiệu suất: m thực tiễn =mlt.H/100
4. Bài tập vận dụng
Câu 1: đến 23 gam rượu etylic nguyên chất tác dụng với natri dư. Thể tích khí H2 bay ra (đktc) là bao nhiêu?
Câu 2: mang lại 23 gam rượu etylic nguyên chất công dụng với natri dư. Thể tích khí H2 bay ra (đktc) là bao nhiêu?
Câu 3: đến 11,2 lít khí etilen (đktc) chức năng với nước tất cả axit sunfuric (H2SO4) có tác dụng xúc tác, thu được 9,2 gam rượu etylic. Hiệu suất phản ứng là bao nhiêu?
Câu 4: Cần bao nhiêu thể tích rượu nguyên chất cho vào 60 ml hỗn hợp rượu 40o thành rượu 60o?
Câu 5. Khí CO2 xuất hiện khi lên men rượu một lượng glucozơ được dẫn vào dung dịch Ca(OH)2 dư tạo ra 40 gam kết tủa. Khối lượng ancol etylic chiếm được là
Câu 6. Hòa hợp 23,8 g muối M2CO3 cùng RCO3 vào HCl thấy thoát ra 0,2 mol khí. Cô cạn dung dịch thu được từng nào gam muối bột khan.
Câu 7. Cho 20,15 gam tất cả hổn hợp 2 axit no đối kháng chức tính năng vừa đầy đủ với hỗn hợp Na2CO3 thì nhận được V lít khí CO2 (đktc) với dung dịch muối. Cô cạn hỗn hợp thì nhận được 28,96 gam muối. Giá trị của V là?
Câu 8. Đốt cháy trọn vẹn m gam hợp chất hữu cơ A phải dùng 11,2 gam khí oxi, chiếm được 8,8 gam CO2 và 5,4 gam H2O. Ở đktc 2,24 lít khí A có cân nặng 3 gam. Khẳng định CTPT của A?
Câu 9: X mạch hở bao gồm công thức C3Hy. Một bình bao gồm dung tích không đổi chứa các thành phần hỗn hợp khí X với O2 dư ngơi nghỉ 150ºC, áp suất 2 atm. Nhảy tia lửa điện để đốt cháy X sau đó đưa bình về 150ºC, áp suất vẫn chính là 2 atm. Công thức phân tử của X?
Câu 10: lúc đốt cháy trọn vẹn 15 mg hóa học A chỉ nhận được khí CO2 và hơi nước, tổng thể tích của chúng quy về đktc là 22,4 ml. CTĐGN của A?
Như vậy, bài viết đã khiến cho bạn Nắm có thể 10 Điểm Hóa Với những Công Thức chất hóa học Lớp 9. mong muốn những kỹ năng mà Trung trọng điểm WElearn gia sư share có thể góp ích cho mình trng việc học xuất sắc môn hóa hơn. Chúc bạn thành công nhé!














